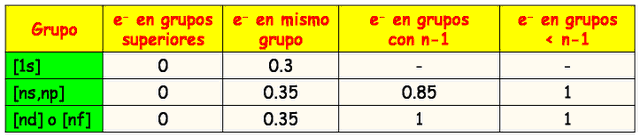
4.Propiedades Periódicas y Su Variación En La Tabla Periódica.
4.1. Tamaño De Los Átomos Radios Atómico e Ionicos.
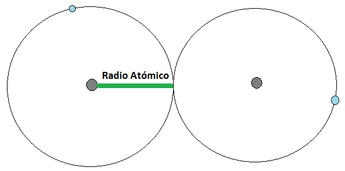
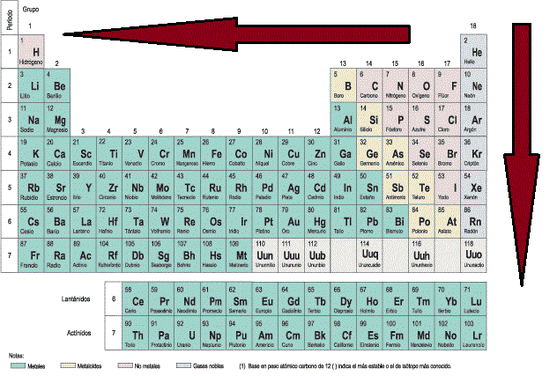
Radio Atómico: El radio atómico se define como la distancia media que existe entre los núcleos atómicos de dos átomos que se encuentren unidos mediante un enlace (los enlaces atómicos se verán en detalle un poco más adelante). Para los átomos que se unan mediante una cesión de electrones, el radio atómico corresponde a la distancia indicada en la Imagen 12 (a) [izquierda], mientras que los que se unan mediante una compartición de electrones, el radió atómico se representa tal y como aparece en la Imagen 12 (b) [derecha]. Para esta consideración se considera al átomo como una esfera. El radio atómico aumenta a medida que se aumenta en el período y a medida que se baja en el grupo.
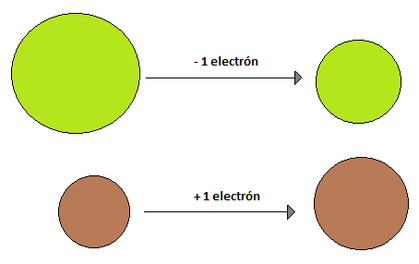
Radio Iónico: El radio iónico se define en relación a iones. Un ion es una especie química con carga, ya sea esta positiva o negativa, y se originan debido a que los elementos tratan de parecerse al gas noble más cercano (elementos del grupo 18), ya que estos tienen una estabilidad superior debido a que sus niveles energéticos se encuentran completos. El término ion significa "ir hacia" y hace referencia a un circuito eléctrico, es por eso que las sustancias cargadas positivamente se llaman cationes (van hacia el cátodo, polo negativo) y las sustancias cargadas negativamente se llamananiones (van hacia el ánodo, polo positivo). Pero, ¿qué hace que exista esta especie química cargada? La respuesta es la ganancia o pérdida de electrones. Como un átomo es eléctricamente neutro, cuando, por ejemplo, gana un electrón de más queda con cargado con un -1 mientras que si pierde un electrón queda cargado con un +1. La capacidad de un átomo para ganar o perder electrones está dado por su electronegatividad, electropositividad, energía de ionización y electroafinidad (propiedades que se verán más adelante). El radio iónico de una especie que ha perdido un electrón es menor que el radio atómico original, esto se debe a que como existe una carga positiva más que negativa, los electrones se sienten mucho más atraídos hacia el núcleo, reduciendo el radio. Por su parte, cuando un elemento gana un electrón, su radio iónico es mayor que su radio atómico de origen, debido a que ese último electrón que entró no se encuentra tan atraído hacia el núcleo y hace aumentar el radio (Imagen 14). El radio iónico, al igual que su par atómico, aumenta a medida que se "baja" en un grupo, pero a diferencia del radio atómico, no presenta una tendencia clara de crecimiento en un periodo, ya que depende del ion (y algunos elementos tienen más de un ion posible, como Cu, Fe, Mn, etc.)
o. Llegando a este punto es preciso dar una justificación de porque estas dos propiedades periódicas aumentan en las direcciones indicadas y no en otra. Para poder comprender el porqué de este comportamiento es necesario incluir el término de carga nuclear efectiva (Zef). Partiremos definiendo la carga nuclear o número atómico. El número atómico (Z) es la cantidad de protones que contiene un núcleo atómico y se coloca al lado del símbolo químico del elemento (específicamente arriba a la izquierda del elemento). Otro valor que se encuentra es la masa atómica (A), el cual corresponde a la suma total de protones y neutrones del átomo y se localiza abajo a la izquierda del símbolo químico del átom
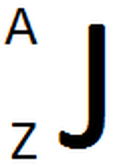
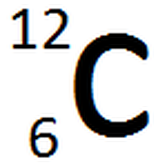
4.2. Energía De Ionización.
La energía de ionización, también llamada potencial de ionización, es la energía que hay que suministrar a un átomo neutro, gaseoso y en estado fundamental, para arrancarle el electrón más débil retenido.
Podemos expresarlo así:
X + 1ªE.I.
Siendo esta energía la correspondiente a la primera ionización. La segunda energía de ionización representa la energía necesaria para arrancar un segundo electrón y su valor es siempre mayor que la primera, ya que el volumen de un ión positivo es menor que el del átomo neutro y la fuerza electrostática es mayor en el ión positivo que en el átomo, ya que se conserva la misma carga nuclear:
X+ + 2ªE.I.
Puedes deducir tú mismo el significado de la tercera energía de ionización y de las posteriores.
La energía de ionización se expresa en electrón-voltio, julios o en Kilojulios por mol (kJ/mol).
1 eV = 1,6.10-19 culombios . 1 voltio = 1,6.10-19 julios
En los elementos de una misma familia o grupo la energía de ionización disminuye a medida que aumenta el número atómico, es decir, de arriba abajo.
En los alcalinos, por ejemplo, el elemento de mayor potencial de ionización es el litio y el de menor el francio. Esto es fácil de explicar, ya que al descender en el grupo el último electrón se sitúa en orbitales cada vez más alejados del núcleo y, además, los electrones de las capas interiores ejercen un efecto de apantallamiento frente a la atracción nuclear sobre los electrones periféricos por lo que resulta más fácil extraerlos.
En los elementos de un mismo período, la energía de ionización crece a medida que aumenta el número atómico, es decir, de izquierda a derecha.
Esto se debe a que el electrón diferenciador está situado en el mismo nivel energético, mientras que la carga del núcleo aumenta, por lo que será mayor la fuerza de atracción y, por otro lado, el número de capas interiores no varía y el efecto de apantallamiento no aumenta.
Sin embargo, el aumento no es continuo, pues en el caso del berilio y el nitrógeno se obtienen valores más altos que lo que podía esperarse por comparación con los otros elementos del mismo período. Este aumento se debe a la estabilidad que presentan las configuraciones s2 y s2p3, respectivamente.
La energía de ionización más elevada corresponde a los gases nobles, ya que su configuración electrónica es la más estable, y por tanto habrá que proporcionar más energía para arrancar un electrón. Puedes deducir y razonar cuáles son los elementos que presentan los valores más elevados para la segunda y tercera energías de ionización.
|

4.3. Afinidad Electrónica.
La afinidad electrónica (AE) o electroafinidad se define como la energía liberada cuando un átomo gaseoso neutro en su estado fundamental (en su menor nivel de energía) captura un electrón y forma un ion mononegativo:
- .
Dado que se trata de energía liberada, pues normalmente al insertar un electrón en un átomo predomina la fuerza atractiva del núcleo, tiene signo negativo. En los casos en los que la energía sea absorbida, cuando ganan las fuerzas de repulsión, tendrán signo positivo; AE se expresa comúnmente en el Sistema Internacional de Unidades, en kJ·mol-1.
También podemos recurrir al proceso contrario para determinar la primera afinidad electrónica, ya que sería la energía consumida en arrancar un electrón a la especie aniónica mononegativa en estado gaseoso de un determinado elemento; evidentemente la entalpía correspondiente AE tiene signo negativo, salvo para los gases nobles y metales alcalinotérreos. Este proceso equivale al de la energía de ionización de un átomo, por lo que la AE sería por este formalismo la energía de ionización de orden cero.
La afinidad electrónica es la cantidad de energía absorbida por un átomo aislado en fase gaseosa para formar un ión con una carga eléctrica de -1. Si la energía no es absorbida, sino liberada en el proceso, la afinidad electrónica tendrá, en consecuencia, valor negativo tal y como sucede para la mayoría de los elementos químicos; en la medida en que la tendencia a adquirir electrones adicionales sea mayor, tanto más negativa será la afinidad electrónica. De este modo, el flúor es el elemento que con mayor facilidad adquiere un electrón adicional, mientras que el mercurio es el que menos.
Aunque la afinidad electrónica parece variar de forma caótica y desordenada a lo largo de la tabla periódica, se pueden apreciar patrones. Los no metales tienen afinidades electrónicas más bajas que los metales, exceptuando los gases nobles que presentan valores positivos por su estabilidad química, ya que la afinidad electrónica está influida por la regla del octeto.
Los elementos del grupo 1, tienden a ganar un electrón y formar aniones -1, completando el subnivel s, mientras que los elementos del grupo 2, que ya lo tienen completo, no presentan esa tendencia. Análogamente sucede en el bloque p, donde las afinidades electrónicas se van haciendo más negativas a medida que nos acercamos a los gases nobles.

4.4. Electronegatividad y Carácter Metálico.
La electronegatividad es un concepto químico más que una propiedad de los elementos aunque, por supuesto, el valor de dicha magnitud depende de su comportamiento químico.
La electronegatividad (EN) mide la mayor o menor atracción -y, por tanto, desplazamiento-que un átomo ejerce sobre el par de electrones de un enlace con otro átomo.
Su valor se determina a partir de una escala. La más utilizada es la de Pauling, en la que, de forma arbitraria, el F tiene EN 4,0 y el Cs 0,7.
Ésta es la propiedad relevante en relación con la capacidad de combinación de los átomos y el tipo de enlace que forman.
Fíjate en la imagen para deducir cómo evoluciona la EN. El color rojo indica valores altos de la propiedad, y el amarillo valores bajos. El color gris indica que no hay datos: como los gases nobles no forman enlaces, no se puede determinar EN para ellos.
 |
 .
.